APA ITU ALUMUNIUM?
BAHAN DASAR ALUMUNIUM – Aluminium adalah salah satu unsur kimia dengan lambang Al dan nomor atomnya 13. Aluminium termasuk ke dalam unsur yang sangat melimpah pada kerak dibumi. Aluminium termasuk logam golongan utama (IIIA) yang bersifat amfoter dan ringan bersama magnesium dan platina.

HARGA ALUMUNIUM
Harga aluminium mulanya memang mahal, bahkan hampir sama seperti harga emas. Karena sifatnya yang ringan dan sangat kuat. Napoleon III pernah memerintahkan untuk membuat baju prajuritnya berbahan dasar aluminium menggantikan baju besi. Karena harga aluminium yang sangat mahal ini, pada saat makan Napoleon III memakai sendok garpu dari aluminium, namun tamunya memakai sendok garpu emas dan perak.
PROSES PENGOLAHAN BIJI ALUMUNIUM
Pada tahun 1825, pertam kali Alumunium telah berhasil dipisahkan dengan senyawanya dengan cara mereduksi aluminium klorida oleh Orsted, namun masih belum dalam kondisi murni. Pada tahun 1827, Aluminium murni ditemukan oleh Wohler dalam wujud serbuk berwarna abu-abu dengan memodifikasi proses Orsted.
Kini proses yang digunakan untuk mendapatkan aluminum secara besar-besaran digunakan proses Hall-Heroult. Cara ini ditemukan oleh dua orang yang umurnya sama (23 tahun), namun di lokasi yang berbeda, yakni Charles Martin Hall di Amerika dan Heroult di Paris pada tahun 1886.
Proses ini membuat kedua orang ini mendadak kaya dalam waktu singkat dan meninggal dunia pada tahun yang sama pula (1914). Setelah ditemukan cara ini harga aluminium yang awalnya sangat mahal menjadi turun secara drastis.
Bijih aluminum yang penting sebagai sumber aluminum adalah bauksit. Bauksit yang dihasilkan dari tambang dihancurkan kemudian dihaluskan menjadi serbuk menggunakan alat-alat tertentu, biasanya Ballmil. Setelah halus ditambahkan larutan NaOH pekat untuk melarutkan Al2O3 yang ada dalam bauksit sedangkan zat lain tidak larut.
Pencampuran Senyawa
Al2O3(s) + 2NaOH(aq) ―→ 2NaAlO2(aq) + H2O(l)
Setelah dilakukan pemisahan larutan NaAlO2 diasamkan sehingga terbentuk endapan Al(OH)3.
NaAlO2(aq) + H2O(l) + HCl(aq) ―→ Al(OH)3(s) + NaCl(aq)
Endapan Al(OH)3 disaring kemudian dipanaskan pada suhu sekitar 1150°C sehingga terurai menjadi Al2O3 dan uap air.
Al(OH)3(s) ―→ Al2O3(s) + 3H2O(g)
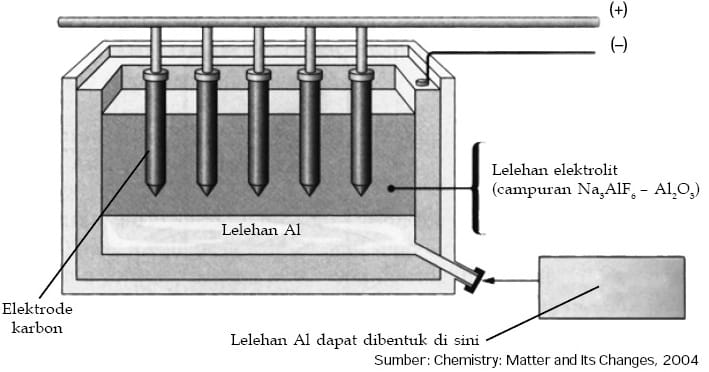
Al2O3 inilah yang akan direduksi menjadi aluminium secara elektrolisis dalam suatu bejana yang disebut sel Hall-Heroult. Sebelum proses elektrolisis dilakukan, alumina dilelehkan terlebih dahulu dalam kriolit. Fungsi kriolit disini untuk menurunkan titik leleh alumina yang awalnya sekita 2000°C menjadi 900°C.
Lelehan alumina yang didapatkan kemudian dimasukkan ke dalam suatu bejana untuk proses elektrolisis yang disebut sel Hall-Heroult. Bejana yang digunakan terbuat dari besi dilapisi grafit yang sekaligus berlaku sebagai katoda. Sedangkan anoda digunakan batang-batang grafit yang dicelupkan ke dalam larutan.
Proses Pematangan
Ketika arus listrik dijalankan ion-ion Al3+ yang ada dalam larutan akan bergerak menuju katoda, yang kemudian direduksi menjadi aluminium cair sedangkan ion-ion O2ˉ akan bergerak menuju anoda kemudian dioksidasi menjadi gas oksigen. Berikut reaksi yang terjadi dalam sel elektrolisis.
- Al2O3(l) ―→ 2Al3+(aq) + 3O2‾(aq)
- Katoda : Al3+(l) + 3e ―→Al(l) × 4
- Anoda : 2O2‾(l) ―→ O2(g) + 4e × 3
- 4Al3+(aq) + 6O2‾(aq) ―→ 4Al(l) + 3O2(g)
Aluminium cair yang diperoleh dialirkan keluar dari sel kemudian suhu diturunkan suhu agar diperoleh aluminium padat. Aluminium yang diperoleh dalam bentuk cair karena suhu di dalam sel elektrolisis melebihi titik leleh aluminium yang hanya 660°C.
Oksigen yang dihasilkan pada anoda dapat bereaksi dengan grafit yang digunakan membentuk gas karbon dioksida dan karbon monooksida. Akibatnya anoda lama-kelamaan akan berkurang dan perlu diganti pada saat-saat tertentu.
SIFAT DAN KELEBIHAN ALUMUNIUM
Sifat Alumunium
- Penghantar listrik dan panas yang baik walaupun tidak sebaik tembaga. Karena memiliki daya hantar listrik yang baik ini aluminiumdigunakan pada kabel listrik menggantikan tembaga yang harganya lebih mahal.
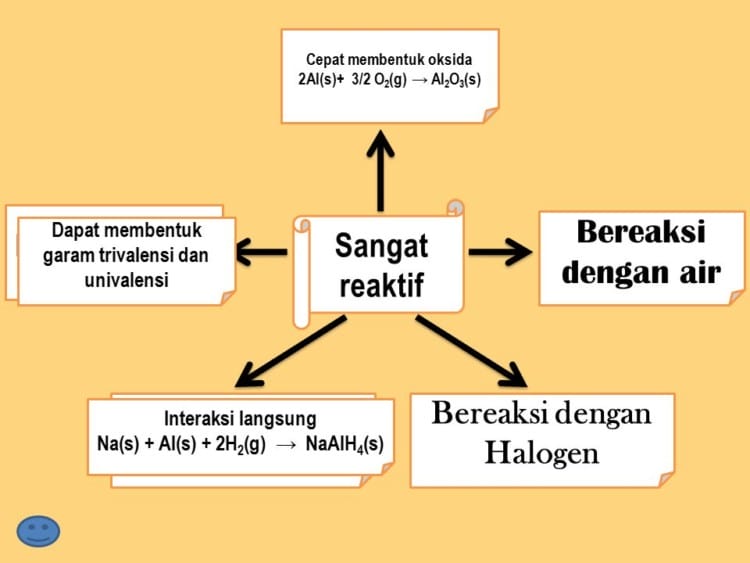
- Memiliki warna yang stabil seolah-olah tidak berkarat. Hal ini disebabkan aluminium sangat cepat bereaksi dengan oksigen yang ada di udara menghasilkan aluminium oksida.
Oksida yang terbentuk tidak mudah terkelupas sehingga dapat melindungi permukaan aluminium yang ada dibagian bawah agar tidak terjadi oksidai berlanjut. Selain berupa lapisan tipis, oksida yang terbentuk merupakan lapisan tembus cahaya sehingga aluminium seolah-olah tidak berubah (tetap mengkilat).
- Permukaannya tidak perlu di cat karena sudah cukup bagus dan menarik.
- Serbuk aluminium yang sangat halus tampak mengkilat seperti logam aslinya sehingga sering dicampur pada minyak cat (vernis) menghasilkan cat metalik yang harganya relatif labih mahal dibanding cat biasa.
Cat-cat metalik kebanyakan digunakan pada barang-barang mewah, karena dengan penambahan aluminium, cat dapat memantulkan cahaya yang lebih banyak.
- Tidak bereaksi dengan asam atau bahan kimia lain yang terdapat dalam bahan makanan. Oleh karena itu aluminium banyak digunakan sebagai bahan dasar pembuatan alat-alat rumah tangga misanya panci.
Dan aluminium dijadikan kertas aluminium yang sangat tipis yang digunakan sebagai pembungkus rokok, gula, bumbu masak dan beberapa keperluan lain.
- Paduan 95% aluminium dengan 5% unsur lain seperti Cu, Mg, dan Mn dapat digunakan menggantikan fungsi besi walaupun tidak sekuat besi. Misalnya dalam pembuatan bingkai pintu dan jendela.
Kelebihan Penggunaan Alumunium
Penggunaan aluminium makin lama makin penting sejalan perkembangan teknologi. Hal ini didukung oleh oleh sifatnya yang menarik dengan harga yang relatif murah. Selain itu aluminium termasuk logam yang ringan bersama-sama dengan magnesium dan titanium.
Reaksi antara aluminium dengan Fe2O3 dikenal dengan reaksi termit yang dihasilkan panas untuk pengelasan baja.
2Al(s) + Fe2O3(s) ―→ Al2O3(s) + Fe(l) ∆H = -852 kJ
Beberapa senyawa aluminium yang banyak digunakan dalam kehidupan sehari-hari dan industri, antara lain:
Tawas, KAl(SO4)2.12H2O digunakan untuk mengendapkan kotoran pada penjernihan air.
- Aluminium sulfat Al2(SO4)3 digunakan dalam industri kertas dan mordan (pengikat dalam pencelupan).
- Zeolit Na2O Al2O3.2SiO2 digunakan untuk melunakkan air sadah.
- Aluminium Al2O3 untuk pembuatan aluminium, pasta gigi, industri keramik, dan industri gelas.